阿茲海默症的病理機制相當複雜,雖有許多研究團隊和藥廠投入研發治療阿茲海默症的藥物,但成果有限。此外,參與藥物研發研究的患者多已有症狀,時機太晚,也失去提早改善的機會。
現在,衛采製藥(Eisai Co., Ltd.)和美國百健(Biogen Inc.)兩大藥廠合作研發的阿茲海默症治療藥物Lecanemab,在11月29宣布已經在三期的臨床試驗得到有效的成果,這是一項重大突破。
Lecanemab是一種單株抗體,它可以與可溶性類澱粉蛋白(Amyloid β; Aβ)、原纖維絲(protofibril)專一結合,達到中和和清除Aβ的功效,減少Aβ在腦中的沉積,等於阻斷阿茲海默症的致病機制。
此試驗共有1795位有認知功能損傷的早期阿茲海默症患者參與,分為Lecanemab組(898人)或安慰劑組(987人),依照雙盲、1:1隨機分配原則,受測者接受10 mg/kg Lecanemab的靜脈注射 (每兩周一次)或安慰劑,整個試驗為期18個月。期間使用多項神經心理評估量表確認認知功能變化,並使用正子造影(PET)確認腦中Aβ的沉積情況。
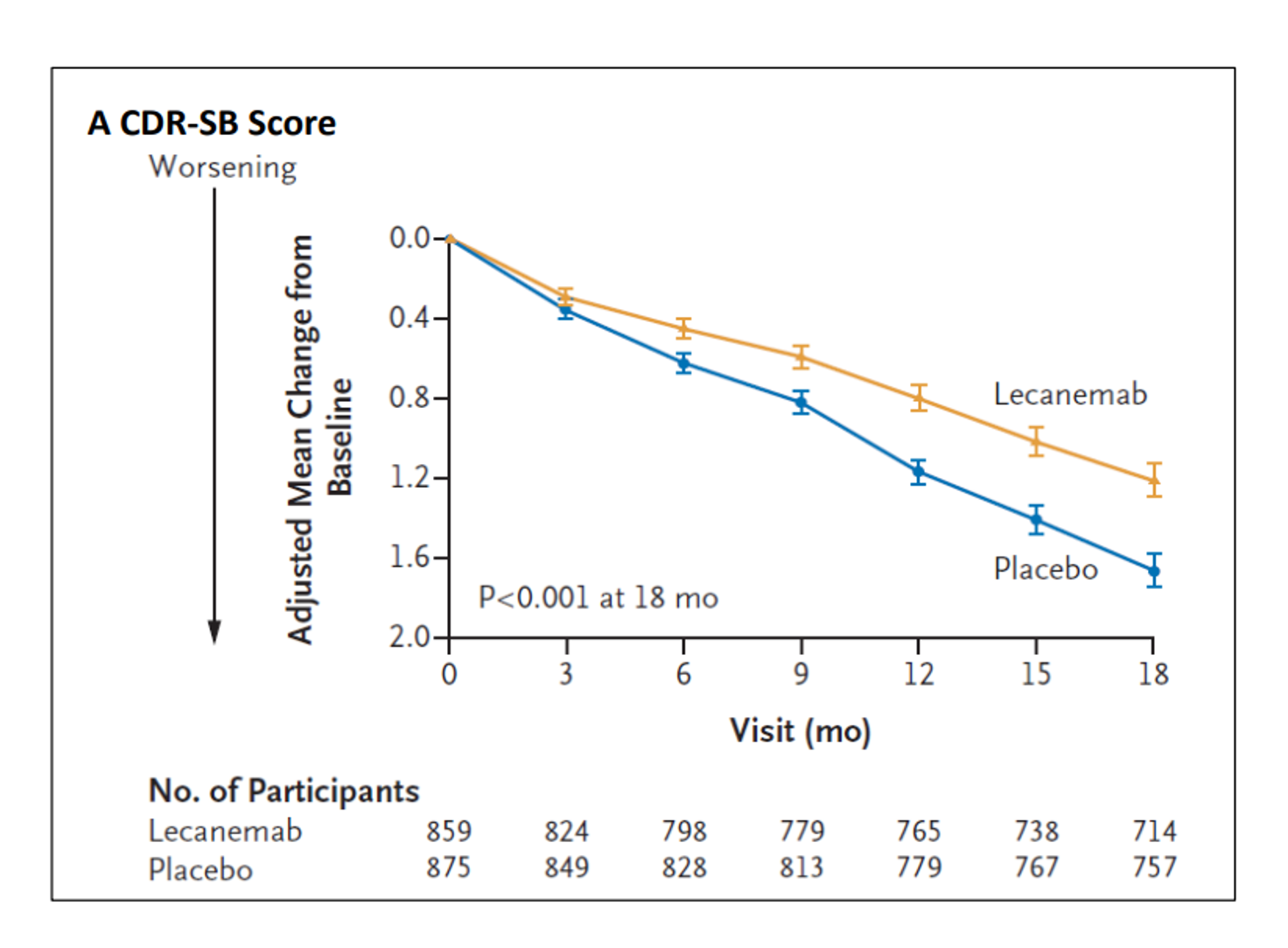
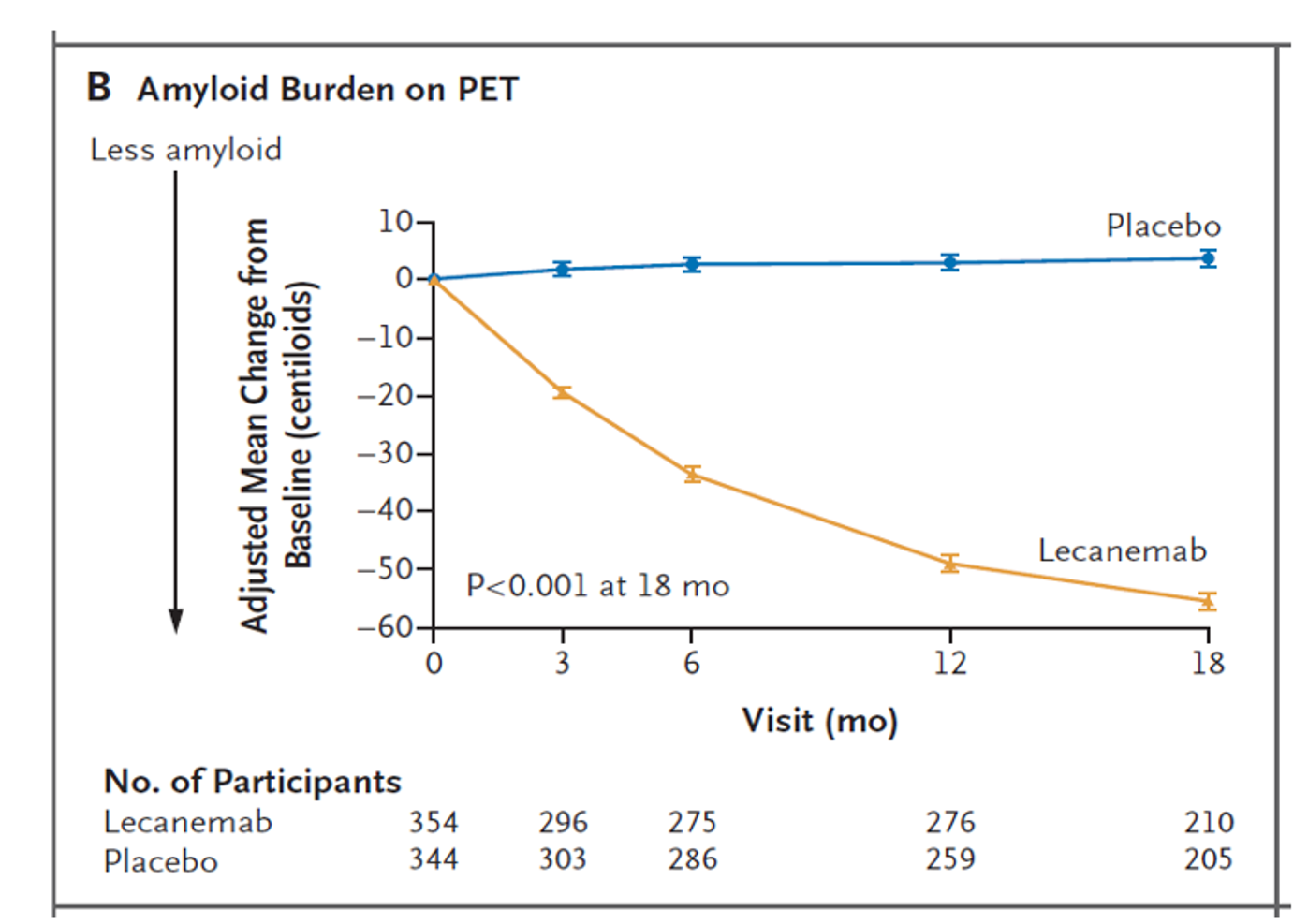
與安慰劑相比,Lecanemab在第3個月開始就有減緩認知退化速度差異,且18個月內使早期阿茲海默症患者的認知退化速度減緩27% (圖A),其他評估指標相較於安慰組,Lecanemab皆可達顯著差異(p<0.001),不過研究中也指出藥物使用中有不良反應,如輸液反應、腦水腫和出血。在PET的類澱粉蛋白分析中,Lacanemab治療從3個月開始的所有時間點,都可以發現腦中類澱粉蛋白斑塊均顯著降低(圖B)。
以上結果已經發表於The New England Journal of Medicine. 2022 Nov 29.
摘自: van Dyck CH et al., Lecanemab in Early Alzheimer’s Disease. N Engl J Med. 2022 Nov 29.
與Lecanemab相似的抗體藥物Aducanumab(商品名Aduhelm),在2021年6月已經通過美國FDA許可上市,過程雖有些爭議,但是在使用上仍建議需要有Amyloid檢測以確認疾病與類澱粉蛋白病理機制相關。
本次試驗提供了類澱粉蛋白抗體藥物在早期阿茲海默症治療上有效的臨床證據,衛采製藥已循「加速審核」的管道由美國監管機關評估,預計將在明年3月以前申請完全批准lecanemab,有望基於新結果申請在其他地區的銷售許可。


