2025年台大神經內科邱銘章教授團隊發表在ACS OMEGA國際期刊的研究成果,顯示要精準檢測Aβ1-42 寡聚體(oligomer),建議使用免疫磁減量(IMR)技術。1
什麼是 Aβ1-42寡聚體(oligomer)?
醫學研究已知大腦中乙型類澱粉蛋白(Amyloid Beta 1-42;Aβ1-42)的累積與認知功能退化有關。血漿中的Aβ1-42蛋白是以單體(monomer)、二聚體(dimer)、寡聚體(oligomer,指得是幾個單體聚集為小團)等等形式存在。研究發現寡聚體(oligomer)相較於單體,對阿茲海默症更具有關聯性,越多oligomer,神經損傷就越嚴重,認知功能退化也相對越快。2,3,4
研究背景
目前可以使用腦脊髓液(CSF;需要進行腰椎穿刺才能抽到)或正子造影(PET)來檢測腦中Aβ的累積程度,但還是會因為侵略性和價錢因素,使得臨床使用受阻。
現在發展中的新興技術,是使用超靈敏方法學來偵測血漿中Aβ1-42,除了發現血漿中的Aβ1-42和Tau與阿茲海默症一樣有極高的相關度之外,只要抽血就可以執行,是相對更簡便又精準的檢測。這種血漿檢測發展較成熟的有IMR和SIMOA兩種方法。
研究方法與結果
台大邱銘章醫師為了釐清不同方法學的偵測差異,實驗先使用3組已知濃度的合成Aβ1-42蛋白檢體,經西方墨點法(Western blot)確認Aβ1-42蛋白的monomer和oligomer分布比例後,再用SIMOA和IMR方法上機檢測。結果發現在oligomer比較多的2和3號檢體,SIMOA方法檢測數據會下降,但IMR方法檢測則仍然有穩定的數據,顯示IMR方法可以同時靈敏偵測到Aβ1-42的monomer和oligomer。
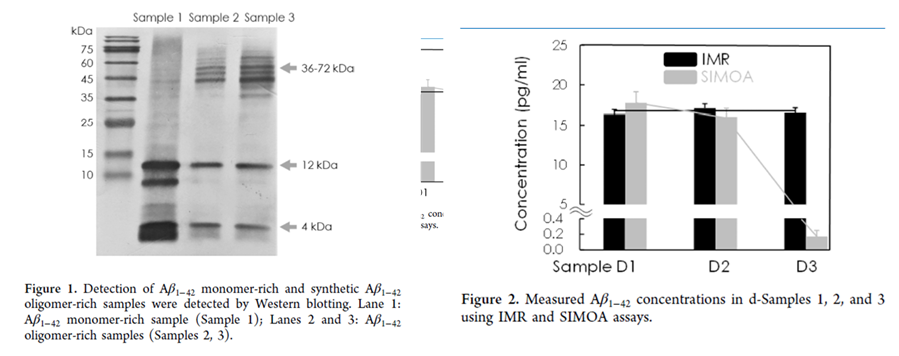
圖1,2 .研究者選用3份合成檢體,這3個檢體的Aβ1-42濃度分別為1號16.36 ±1.78 pg/mL、2號17.09 ± 1.45 pg/mL、3號16.51 ± 0.88 pg/mL。以西方墨點法確認檢體2和3有較高Oligomer(左圖),在使用IMR 和SIMOA兩個不同方法偵測下,IMR方法顯現穩定的濃度,但SIMOA方法則在Oligomer含量較高的2、3號檢體則會偵測不到而讓濃度顯示降低。
另外,研究者再招募10位認知正常者和10位AD患者,一樣採取血漿檢體用SIMOA和IMR方法偵測,發現IMR方法在數據上可以區分正常和AD族群(P<0.0001),但SIMOA則無明顯差異(P>0.05)。
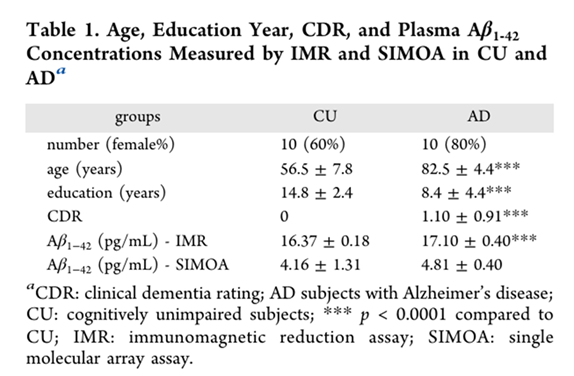
圖2. 以IMR和SIMOA兩種方法來檢測10位認知正常和10位AD患者血中的Aβ1-42濃度。結果顯示IMR方法可以鑑別兩族群的差異。
作者認為這個差異可能跟兩種方法學的不同有關,SIMOA的方法類似於酵素結合免疫吸附分析法(ELISA),Aβ抗體抓到Aβ單體雖沒有甚麼問題,但若是oligomer,則可能會遮蔽掉原本抗體可以辨識到Aβ蛋白上的位置,或因為分子大而使得整個分子在反應盤中分布受影響,也可能讓抗體上的螢光無法充分顯現,因而影響其檢測效能。
但是,IMR方法的原理是奈米磁珠上面包覆一層待檢測物的專一抗體,利用機器讓磁珠轉動,當Aβ抗體抓到Aβ蛋白後分子變大,磁珠也變重轉動變慢,可以從轉速變化而得知Aβ濃度,這時若是抗體抓到Aβ的oligomer,就只會讓抗體抗原分子變得更大,讓整個磁珠轉速慢得更明顯,因而更可以靈敏準確的測得其濃度。在偵測對於疾病更相關的oligomer,IMR方法的確更佔優勢。
參考資料
- Ultrasensitive Assays Detect Different Conformations of Plasma β Amyloids. Li, Chia-Yu et al., ACS Omega, 10, 7256−7263 (2025)
- Ziehm, T.; Buell, A. K.; Willbold, D. Role of hydrophobicity and charge of amyloid-beta oligomer eliminating d-peptides in the interaction with amyloid-beta monomers. ACS Chem. Neurosci. 2018,9 (11), 2679−
- Sonar, K.; Mancera, R. L. Characterization of the conformations of amyloid beta 42 in solution that may mediate its initial hydrophobic aggregation. J. Phys. Chem. B 2022, 126 (40),7916−
- Kim, S.; Lee, H. J.; Nam, E.; Jeong, D.; Cho, J.; Lim, M. H.;You, Y. Tailoring hydrophobic interactions between probes and amyloid-β peptides for fluorescent monitoring of amyloid-β aggregation. ACS Omega 2018, 3 (5), 5141−


